Cours d’orpaillage: Géochimie, mobilisation et précipitation de l’or dans les cycles d’érosions
Trouver de l’or c’est déjà bien, mais savoir d’où il pourrait provenir et comment celui-ci a été formé, c’est encore mieux, car cela ouvre des nouvelles perspectives de recherches plus intéressantes!
Dans ce dossier spécial, nous allons essayer de comprendre les règles qui régissent les cycles de l’or dans le nature, d’un point de vue chimique, et nous intéresser aussi à sa mobilité.
Dans ce voyage extraordinaire, que je vous invite à découvrir et à partager, nous allons comprendre le rôle essentiel de la nature et de la biologie, notamment celui des plantes, des arbres, des bactéries, des champignons, des racines.
Sans environnement naturel avec un écosystème riche et varié, il n’y aurait tout simplement pas d’or dans nos rivières.
En effet, comme vous allez le constater l’or a besoin de composés organiques biologiques pour migrer, se déplacer, se transporter, se concentrer, et enfin se précipiter. Mais pas que…
Tout le monde le sait, l’or est inoxydable, mais d’autres composants chimiques naturels interagissent avec lui dans la nature, il peut donc être oxydé, réduit et précipité, dans certaines conditions physico-chimiques, d’électro-conductivité, et de pH.
Un bon orpailleur ou prospecteur doit bien comprendre les différents mécanismes des cycles de l’or.

SOMMAIRE:
- Introduction
- Observations de résultats de prospections
- Les origines de l’or dans la nature
- Le processus immuable du weathering
- Qu’est ce que le weathering?
- Oxydation
- Hydrations and déshydrations
- Kaolinisation
- Epidotisation
- Chloritisation
- Altération induite par les chocs
- Désintégration radioactive
- Serpentinisation
- Dolomitisation
- Pyritisation
- Opalisation
- Ouralitisation
- Les transports chimiques de l’or
- Les transports mécaniques de l’or
- L’eau et la neige
- Le vent
- Le gel et le froid
- La gravité
- Le biotope joue un rôle essentiel dans le cycle de l’or
- Le rôle des végétaux, plantes et racines
- Le rôle des bactéries
- Le rôle des champignons
- La mobilisation chimique de l’or dans la nature
- Tellures d’or
- Chimie des tellures d’or
- Chlorures d’or
- Chimie des chlorures d’or
- Bromures d’or et les iodures d’or
- Chimie des bromures et iodures d’or
- Thiosulfates d’or
- Chimie des ions Thiosulfates
- Formation de Thiosulfates d’or
- Thiocyanates d’or
- Chimie des ions Thiocyanates
- Les catalyseurs de la précipitation de l’or dans la nature
- Le Fer
- Le Manganèse ou Manganate
- Les argiles et les silicates
- Les Sulfures
- Les substances gélatineuses
- Les métaux réducteurs
- Les minéraux supergènes
- Le Carbone
- Les Sulfates
- Conclusions
- Références

Introduction
L’environnement naturel, tel qui nous entoure, est la scène d’une multitudes de réactions chimiques insoupçonnées qui se déroulent perpétuellement et en permanence, depuis la formation de la Terre.
L’eau est une substance fondamentale présente partout sur la surface du globe, elle fait partie intégrante de tous les êtres vivants, mais aussi des biotopes et des paysages.

Les actions combinées de l’eau, de la météo, des intempéries, du vent, du gel, et de la gravité, ont pour conséquence, la dégradation, l’altération et l’oxydation des roches, perpétuellement, ce processus se nomme par les prospecteurs le weathering.
Le weathering est à la fois un processus mécanique et chimique ; il est microscopique et macroscopique ; enfin, il perceptible et imperceptible.
Le weathering entraine la libération de l’or, par divers processus chimiques, directement liés à l’action du monde végétal et du biotope, ou bien par des actions physiques ou mécaniques.
En fait, la nature crée des complexes chimiques qui permettent le transport et la mobilité de l’or en solutions aqueuses, qui peuvent parfois être transportées sur de très grandes distances.
Dans certaines conditions l’or va précipiter, pour former des grains ou des paillettes.
Le pH (potentiel hydrogène), c’est à dire le fait qu’une solution aqueuse soit acide ou basique est contrôlé par la présence naturelle de nombreux acides.
Spécialement l‘acide sulfurique H2SO4, qui est un sous produit de la dégradation et de l’oxydation de la pyrite et autres sulfures, ou par l’hydrolyse de certains sulfates, surtout les sulfates de fer, mais aussi par les effets neutralisants des roches de type carbonates ou de certaines gangues rocheuses.
L’oxydation de la pyrite de fer par l’oxygène, l’eau ou les hydroxydes, a pour conséquence la formation d’acide sulfurique:
FeS2 + 02 + H20 + OH- => H2SO4
Ainsi, là ou la gangue est riche en quartz, pyrites ou autre sulfures, et le mur du rocher est inerte (non réactif), comme l’ardoise, le schiste, le greywacke, la quartzite, le gneiss, dans lesquelles les conditions sont en général acides, les eaux sont neutralisées très lentement.
Si des ions chlorures sont présents dans l’environnement aurifère, l’or peut migrer et être mobilisé considérablement dans des complexes chimiques de type chlorures d’or en solution aqueuse.
Aussi, l’or à une forte tendance à être absorbé par les hydroxydes de fer, la limonite, les oxydes de manganèse hydreux, qui auront tendance à faire précipiter l’or.
En fait, l’or ne va pas être précipité totalement, à cause des conditions acides (pH <5).
D’un autre coté, là où la roche de l’affleurement est du carbonate, les solutions aqueuses acides sont rapidement neutralisées (pH = 7), et les complexes alcalins de l’or sont alors stabilisé et peuvent permettre une bonne mobilité à l’or.
En outre, une abondance de fer hydrique oxydé et d’oxydes de manganèse sont formés en conditions acides, neutres ou alcalines, et elles tendent à absorber l’or très fortement à pH 5 à 8.
L’or est particulièrement mobile dans les environnements acides ou très alcalin.
Les conditions les plus favorables pour un second enrichissement sont: faiblement acide, neutre ou faiblement alcalin.
En milieu humique, la séquence de mobilité est la suivante:
Zn > Cd = Hg > Ag > Cu = Mo > Co = Ni > Au > Pb > Sn/Bi/W
Quand de la matière organique est présent dans le système, l’ordre de mobilité des différents éléments peut être considérablement modifié, cela dépend du type de complexes humiques présents mais aussi d’autres facteurs.
Il est important de noter que l’or a une grande faculté de transport dans les milieux humiques aqueux et sa mobilité est probablement la même que Ag, Cu, Hg, et Mo.
Il faut bien comprendre qu’en milieu humique, un grand nombre de mécanismes et de réactions chimiques favorisant la précipitation de l’or sont possibles, en provenance des migrations de solutions supergènes aqueuses aurifères.
Le prospecteur ou chercheur d’or devrait donc privilégier les endroits où l’or aura tendance à se précipiter naturellement au delà du fait qu’il peut s’accumuler physiquement dans certains endroits précis (marmites, rifles, failles, racines,…).
Enfin il est conseillé de privilégier les endroits à variations de pH, à la hausse ou à la baisse, et aussi les milieux acides ou basiques, surtout ci-celle-ci sont riches en fer peroxydé ou en oxydes de manganèse.
Observations de résultats de prospections
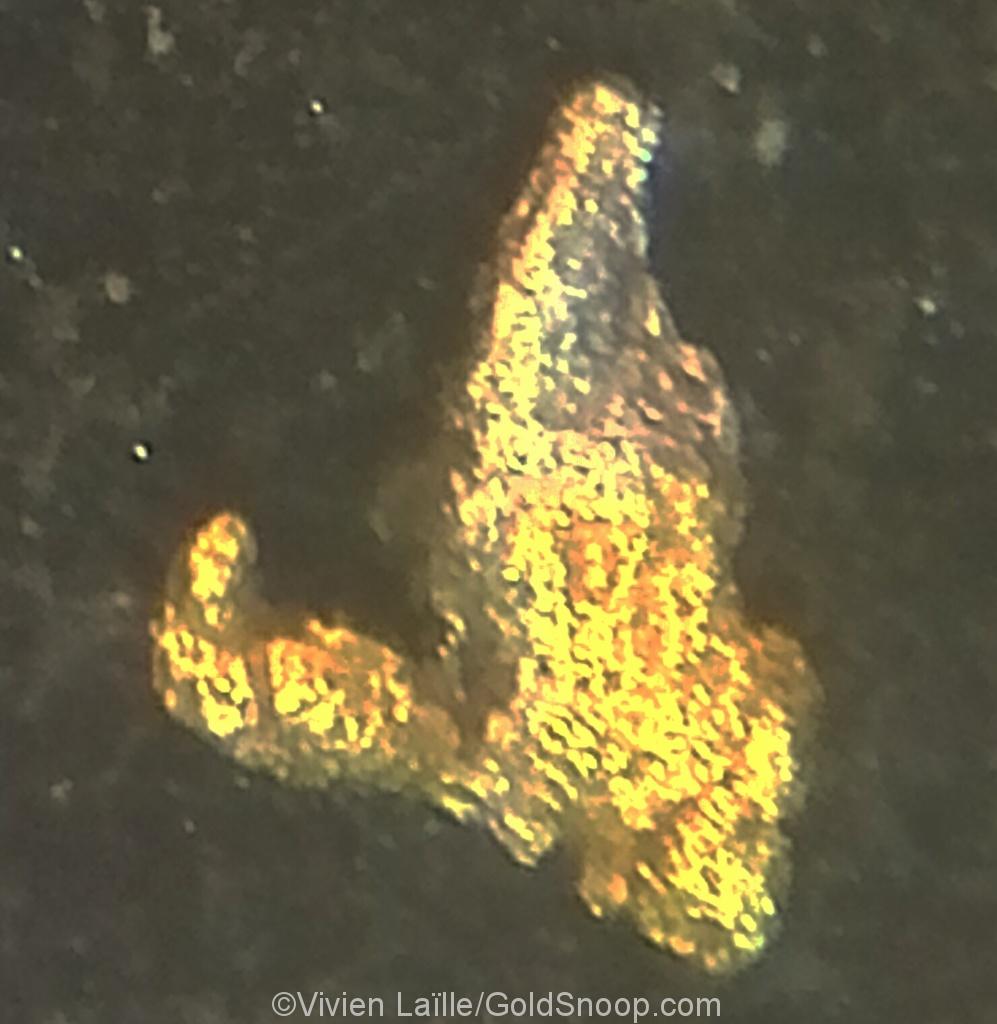
Le fait de trouver des paillettes d’or est une excellente nouvelle mais l’étude attentive de leurs formes, couleurs et textures apporte des informations essentielles pour mieux en comprendre la géochimie, l’histoire et la formation.
Un large éventail de formes et de couleurs, et de très belles paillettes observées au microscope ; la nature est une vraie artiste, et nous offre le privilège de ce spectacle:
Légende des photos, toutes en provenance du Couserans en Ariège:
- 1ère ligne: 1. Grain d’or boursoufflé. 2. Grain d’or boursouflé. 3. Grain d’or plié avec or jaune et électrum gris (alliage or/argent).
- 2ème ligne: 1. Paillette d’or en flaque d’eau plate. 2. Grain d’or fin. 3. Or jaune et électrum gris, alliage d’or et d’argent.
- 3ème ligne: 1. Grain d’or fin très. 2. Paillette d’or pliée et trouée. 3. Grain d’or fin en forme de patate.
Or boursoufflé
Indice d’un or formé en milieu chimique et aqueux supergène ou hypergène (très oxydé).
Or en flaque d’eau plate
Révélateur d’un or qui a été transporté et qui a séjourné longtemps dans la rivière ou par les eaux. Il a subi les actions mécaniques des sables, graviers, galets roulés et rochers au sein de la rivière. Ce type d’or est aplati, et peut aussi être plié.
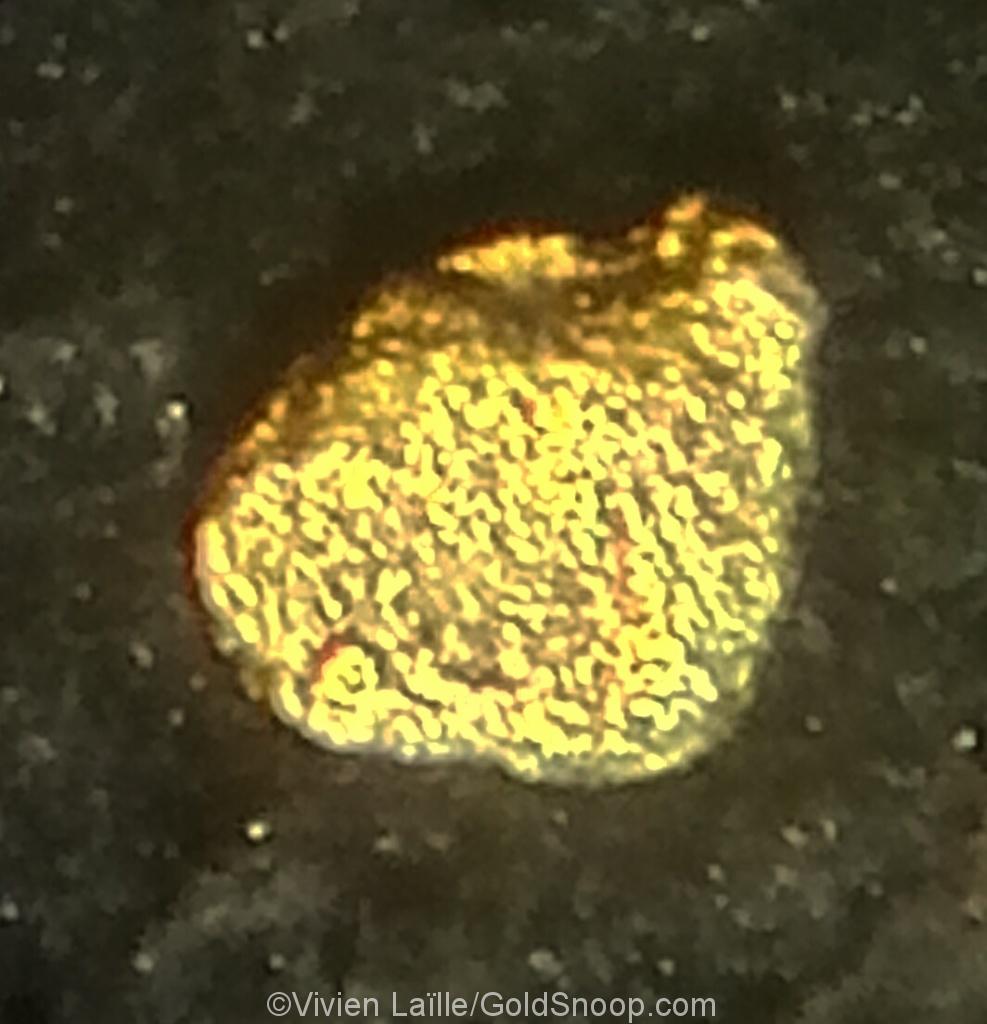
Or à texture spongieuse
Indice d’un or formé en milieu chimique et aqueux supergène ou hypergène (très oxydé).
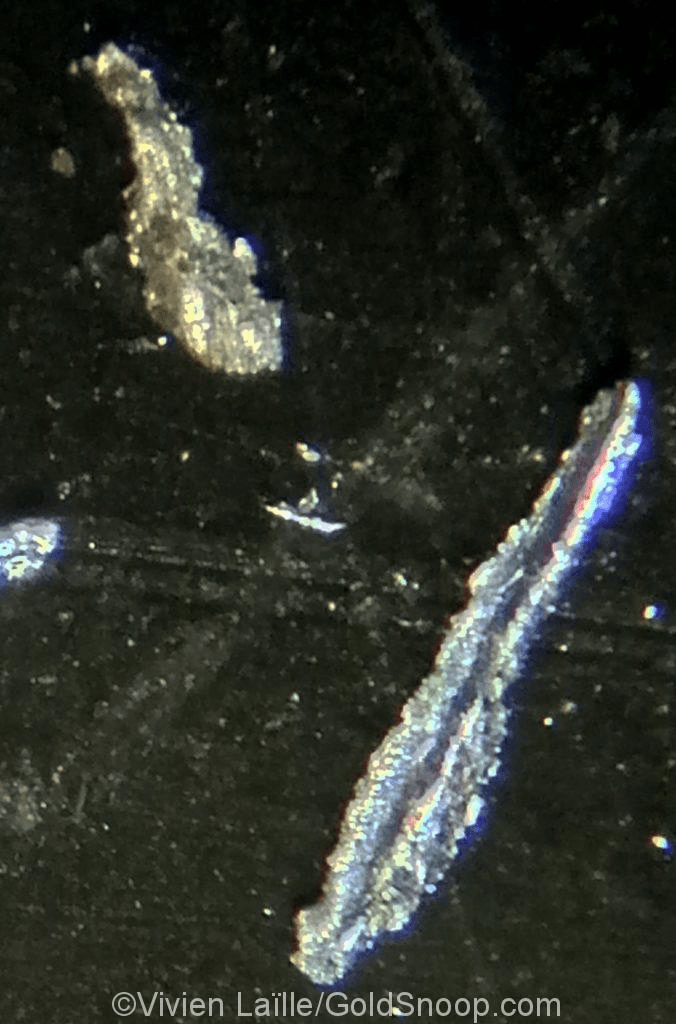
Or gris et or jaune
Indice de présence d’argent. L’or gris ou électrum est un alliage naturel d’or et d’argent. Parfois certains grains ou paillettes d’or peuvent être bicolore. Indice de présence de minerai d’argent et de galène argentifère.
Or en grain/patate
C’est un or formé en place, peu mobilisé et qui a été peu transporté. Il a subi très peu d’actions mécaniques ou physiques.
Je vous invite à consulter l’article sur les formes et les couleurs des paillettes d’or, spécialisé sur ce sujet.
Les origines de l’or dans la nature
Dans une galaxie lointaine, très lointaine…
Avec l’eau, le fer, dans l’Univers, peu d’éléments chimiques peuvent se vanter d’avoir autant voyagé, et de provenir d’aussi loin que l’or.
En effet, il provient d’anciennes étoiles massives mortes qui ont exposées (supernovae) ou de galaxies anciennes ayant fusionnées.
Ces phénomènes spatiaux ont disséminé l’or dans les confins de l’espace.
Le hasard cosmique de la force de gravité a ensuite joué son rôle.

Mais on sous-estime l’origine de cet or dans la mesure où il provient de l’espace et de très très loin!
La formation du système solaire, a concentré ses éléments, pour les regrouper, sous la forme de planètes, d’astéroïdes, ou de météorites, grâce à la gravité.
L’accrétion qui a abouti à la formation des planètes, y compris de la Terre, a classé les éléments chimiques par densité, les plus lourds proches du noyau terrestre, les plus légers, vers la croute terrestre.


Mais comme la Terre renferme de la chaleur en son sein, la lave et les roches en fusion, en provenance des profondeurs, ont disloqué la croute terrestre, pour faire déplacer d’importantes masses de terre, nommées continents.
La dérive des continent, un processus lent et intemporel, est une conséquence visible des mouvements de convection, qui imposent à des matériaux chauds des profondeurs, dont l’or, de remonter à la surface, via les volcans, les rifts, l’hydrothermalisme.
Ce mécanisme géologique, qui peut être perçu par les tremblements de terre, est à l’origine de la formation des rifts, des océans, des chaînes de montagnes, du volcanisme, mais aussi de l’évolution des espèces animales et végétales sur Terre.
Les chaines de montagne, entre autre, les zones de subductions, produisent de l’or en permanence et perpétuellement, ne serait ce que par les activités hydrothermales.
L’histoire géologique dans le monde révèle la présence de roches très anciennes, métamorphiques ou sédimentaires, et leurs études révèlent parfois la présence d’or, dans certains cas bien précis, et cela pour certaines raisons.
Par l’érosion, cet or est libéré et transporté par divers phénomènes physiques et chimiques, pour se déposer et se concentrer dans des gisements secondaires ou dans des lieux de concentrations (placiers, marmites, rifles…).
Le processus immuable du weathering
Le mot « weathering » est un mot anglais, qui signifie « érosion« . Nous allons découvrir dans ce chapitre quels sont les différents processus d’érosion des roches dans la nature.
Nous conserverons l’usage de ce mot technique, faisant partie intégrante du vocabulaire des prospecteurs habitués par son usage.

Les causes principales du weathering sont:
- L’eau, l’atmosphère, qui contiennent de l’oxygène,
- Les variations de pH et d’Ec du milieu,
- Les variations de températures, phénomène de dilatation et de rétractation des roches,
- La gravité, une force physique intrinsèque et omniprésente, qui tendent à faire tomber les roches et les matériaux vers le bas,
- La biodiversité et l’écosystème: plantes, arbres, racines, mousses, lichens, champignons, racines, les actions des animaux, participent à l’érosion et à la météorisation des roches,
- Les réactions chimiques naturelles, qui elles aussi participent à la dégradation des roches.
Qu’est ce que le weathering?
Le weathering regroupe l’ensemble des processus mécaniques ou chimiques qui altèrent, oxydent, érodent les roches à la surface de la planète, pour les réduire en sable ou en argile (ou en limon).

Oxydation
Un exemple courant d’oxydation est lorsqu’un minéral de fer ferreux naturel tel que la pyrite est oxydé pour former de la goethite ou d’autres hydroxydes ou sulfates de fer ferrique.
Hydrations and déshydrations
Le gypse minéral commun est un minéral de sulfate hydraté qui se transforme facilement en sulfate anhydre bien nommé anhydrite avec dessiccation prolongée. C’est une réaction réversible.
CaSO4·2H2O <=> CaSO4
Kaolinisation
La kaolinisation fait référence à l’altération du feldspath alcalin en kaolinite minérale argileuse en présence de solutions légèrement acides. La pluie dissout facilement le dioxyde de carbone (CO2) de l’atmosphère, favorisant l’altération des roches granitiques. Comme démontré dans la réaction suivante, en présence d’acide carbonique et d’eau, le feldspath potassique est transformé en kaolinite, avec l’ion potassium, le bicarbonate et la silice en solution comme sous-produits.
2 KAlSi3O8 + 2 H2CO3 + 9 H2O => Al2Si2O5(OH)4 + 4 H4SiO4 + 2 K+ + 2 HCO3−
Epidotisation
L’épidotisation est le processus d’altération au cours duquel les feldspaths plagioclases se convertissent en minéraux du groupe épidote.
Chloritisation
La chloritisation est l’altération des minéraux de pyroxène ou d’amphibole en minéraux du groupe chlorite. La chloritisation est un processus courant dans les transitions métamorphiques vers le faciès schiste vert et le métamorphisme rétrograde du faciès amphibolite.
Altération induite par les chocs
Comme observé dans et autour des astroblèmes tels que les cratères d’impact, la silice ordinaire ou les cristaux de quartz peuvent altérer les minéraux stishovite et coésite à la suite d’impacts de météorite produisant un environnement de pression extrême et de température élevée.
Désintégration radioactive
Un exemple courant d’altération de la désintégration radioactive est lorsqu’un élément radioactif portant du cristal de zircon ou d’allanite devient métamict ou amorphe en raison de dommages structurels.
Serpentinisation
La serpentinisation est le processus d’altération minérale qui se traduit par la formation d’un groupe de minéraux serpentins principalement à partir du groupe olivine, avec l’hydratation et les changements de pression comme principaux facteurs.
Dolomitisation
La dolomitisation se réfère aux différentes manières suggérées dans lesquelles une roche sédimentaire à forte teneur en calcium riche en calcite comme le calcaire peut se transformer en dolomite de roche riche en dolomite magnésienne. La diagenèse est un coupable probable qui implique des volumes d’eau et une chaleur assez faible, en tant que catalyseur d’échange ionique. La réaction est la suivante:
2CaCO3(limestone) + Mg2+ -> CaMg(CO3)2(dolomite) + Ca2+
Pyritisation
La pyritisation implique le remplacement ionique par des atomes de fer et de soufre qui se combinent pour former la pyrite minérale.
Opalisation
L’opalisation est l’altération de la silice amorphe, souvent sous forme de restes organiques de microfossiles siliceux dans des roches sédimentaires lithifiées, en opale minéraloïde.
Ouralitisation
L’ouralisation est le processus d’altération deutérique du pyroxène (le plus souvent augite) pour former une amphibole (actinolite-trémolite). L’altération se produit au cours des derniers stades de la cristallisation magmatique à basses températures (<500 ° C) ou lors d’événements métamorphiques de bas grade (métamorphisme du faciès sous-schiste vert). La réaction est paramorphique, ce qui signifie que la structure du minéral est modifiée, mais sa chimie d’origine est conservée.
Les transports chimiques de l’or
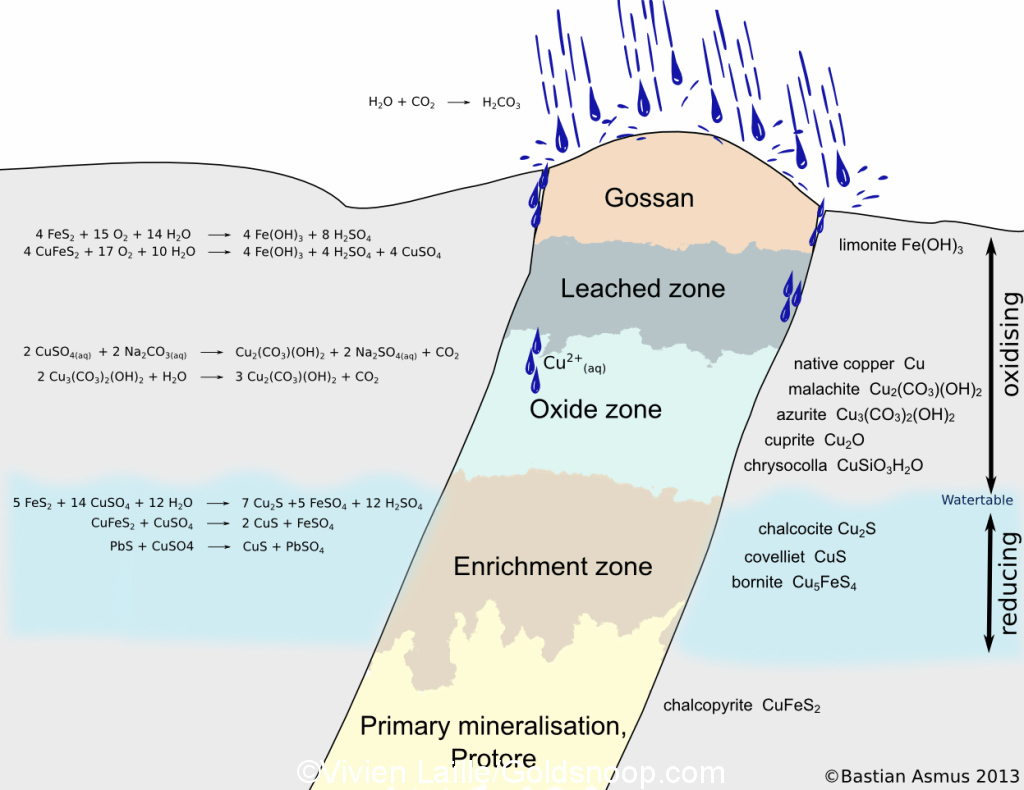
L’oxydation et l’altération des roches intervient dans le processus d’érosion, d’hydratation, en présence d’eau liquide (pluies, intempéries, chutes de neige, rivières, humidité), mais aussi grâce à l’action du biotope.

Les dépôts aurifères soumis à l’oxydation deviendront enrichi proche de la surface, conséquences de processus chimiques qui entraine la migration de l’or par suppression des gangues solubles et des sulfures.
L’or ne s’oxyde pas en tant que tel, mais ce sont les processus chimiques d’oxydation sur d’autres métaux qui vont entrainer la libération de l’or ou sa mobilité dans la nature.
L’oxydation a pour conséquence la migration de l’or ou sa dissémination grâce à la suppression d’une gangue soluble et l’altération des sulfures.
Ces dépôts peuvent être très argentifères et peuvent contenir argentite, tetraedrite, galène, blende, pyrite, c’est à dire beaucoup de sulfures.

Il y a une corrélation entre l’oxydation métallique et l’enrichissement d’un milieu en or:
OXYDATION D’ELEMENTS METALLIQUES <=> POTENTIEL AURIFERE
OXYDES + SULFURES <=> POTENTIEL AURIFERE
OXYDES + SULFURES + FER + MANGANESE <=> POTENTIEL AURIFERE
La mobilité, la migration, la concentration, ou la dispersion de l’or pendant l’oxydation dépend de facteurs suivants:
- du type de minéraux métallique composant le dépôt,
- de la nature de la gangue (pH et Ec),
- des types de sulfures métalliques présents,
- de la présence ou non de filons aurifères quartzeux (quartz fumé, quartz noir, quartz avec des impuretés),
- des types de roches et de minéraux incluant la gangue,
- des types de fracturation des roches, de la zone de chevauchement, constituant le dépôt et des roches encaissantes,
- des facteurs climatiques (le weathering) qui impactent sur les processus d’érosion et d’oxydation: pluie, neige, vent, gel,…
- de la position de la table d’eau, des ruissellement,
- des agencements organiques et biologiques.
Des réactions chimiques entrainent la dissolution ou la précipitation de l’or dans les eaux oxydées supergènes.
En outre, il faut comprendre qu’il y a des réactions chimiques entre ces différents composants durant les phases d’oxydation, qui elles aussi alternent et modifient la nature des roches encaissantes.
Aussi, l’or est soluble dans certains composants organiques, où il peut être associé ou rendu soluble par les produits ou sous-produits de ses agencements organiques.
L’or peut être associé avec un sous produit de l’oxydation: calcite, gypse, sulfure, opale, kaolinite, limonite,…
L’or natif est relativement inerte, spécialement s’il est associé aux sulfures, ou sulfosels, le minéral passe dans les zones oxydées avec les mêmes conditions puisqu’il est présent dans le minerai primaire d’origine.
Dans d’autres conditions, il est dissous et migre sous une variété de formes chimiques, pouvant parcourir de très grandes distances avant de se précipiter/coaguler.
La destinée de l’or dépend, pendant l’oxydation, de l’influence de la nature, et de la taille des particules d’or dans la roche d’origine (roche primaire).
De plus, la solubilité de l’or est plus importante quand l’élément est associé à du fer, de la pyrite, de l’arsenopyrite, ou lorsqu’il est dans un état colloïdal ou des particules <100 µm.
L’or supergène migre dissous ou en particules très fines, en solutions aqueuses, ou sous une forme colloïdale, ou encore, en suspension.
La plupart de cet or migre ainsi sous la forme de plaquettes, petites pépites, plaques irrégulières fines ou paillettes.
L’or présent sous cette forme aura tendance à réduire la migration de l’or ionique aqueux, puisque l’or natif va attirer les ions d’or ; c’est pour cela que les paillettes d’or des rivières grandissent petit à petit avec le temps dans certaines conditions physico-chimiques.
Milieu hypogène (peu oxydé)
- Les principaux minerais hypogènes d’or natif: aurostibite, fischesserite, il y a aussi les tellurides et la sylvanite.
- Comme autres minerais aurifères, figurent: la pyrite aurifère, pryrrhotite, et l’arsenopyrite, et la chalcopyrite.
- Les autres sulfures métalliques: blende, galène.
- Ces minerais contiennent une large portion d’or combiné à d’autres éléments comme le fer, le souffre, le cuivre.

Milieu supergène (très oxydé, aqueux, humique et humide)
- L’or supergène apparaît sous une grande variété de formes, limaces, flaques, pépites, plaquettes, dendrites, fils, brains, touffes, cheveux, filaments, filigranes, masses spongieuses, agrégats, mousses, feuilles.
- L’or le plus fin est appelé « or moutarde ».
- la plupart de l’or qui apparaît dans les milieux supergènes dans les zones oxydées, sous la forme de petites particules très discrètes et autres agrégats.
Ci-dessous: des exemples de paillettes d’or détritique typiques des rivières du Couserans, en Ariège, en France. Découvertes faites après lavage au pan américain de sables en différents endroits de prélèvements. L’aspect spongieux, boursoufflé, en flaque, ou en petits grains très fins et peu aplatis, montrent que celle-ci ont grandies et se sont développées dans un milieu supergène très oxydé.
Rappel des principes actifs qui dissolvent l’or dans la nature:
- Le brome et le chlore attaquent l’or à froid,
- Il faut un mélange d’acide chlorhydrique et d’acide azotique (eau régale) pour dissoudre de l’or,
- Le phosphore et et l’arsenic attaquent l’or à des températures élevées,
- Le mercure attaque l’or a froid, pour l’amalgamer,
- A des températures élevées, l’or peut s’associer à tous les métaux,
- L’or est aussi attaqué avec un mélange de permanganate et d’acide chlorhydrique qui le dissolvent,
- NaCl (Chlorure de sodium), peut dans certaines conditions émettre du gaz de chlore qui dissous l’or.
Dans la nature, les conditions favorables, sinon essentielles, à l’enrichissement en or sont:
- les solutions de chlorure,
- les sulfures de fer,
- les composés du manganèse.
Là où ces conditions sont réunies et où aucun précipitant très efficace n’est à portée de main et où l’érosion n’est pas trop rapide, des dépôts d’or sont rarement formés et les affleurements de minerais d’or sont probablement moins riches que les minerais plus profonds.
Là où ces conditions existent et où les filons sont fracturés, l’or migre vers le bas.
Les transports mécaniques de l’or
L’or des gisements primaires ou secondaires, ou des dépôts d’accumulations aurifères, peuvent être désagrégés et déplacés sur de très grandes distances.
L’eau, la neige, les intempéries, le vent, le gel, et la gravité, sont les facteurs qui ont tendance à fracturer et fractionner les roches, favorisant le processus de weathering et le transport de l’or dans la nature.

L’eau et la neige
En tant que fluide, l’eau est un véhicule qui a la faculté de transporter des particules et des matériaux, allant du limon très fin, au bloc de rocher de plusieurs tonnes.
Un exemple concret valant mieux que des longs discours:





Le vent
Le vent est une force vive toujours présente et toujours en mouvement partout dans le monde, elle ne s’arrête jamais, toujours en circulation.
Il a la faculté de déplacer et de disséminer dans la nature une très grande quantité de partucules, sables et aérosols, parfois sur de très grandes distances (plusieurs milliers de kilomètres).
Par exemple, c’est le vent qui va transporter du sable depuis le Sahara vers la France ou vers l’Amazonie.


Le gel et le froid
Les variations de températures rapides entre le froid et le chaud entrainent la dilatation ou la contraction des roches, qui souvent se brisent.
Aussi, l’eau introduite dans les failles, fentes, et fissures aura tendance à geler sous températures négatives, et la dilatation de l’eau gelée entrainera la fracturation de blocs de roches, pouvant parfois être de grandes tailles.
Le phénomène de gélifraction se déroule à différents niveaux, aussi bien sur des blocs énormes que sur les galets plus petits.


Exemple de fracture de roche par le gel et les variations de températures rapides. 
Altération gel-dégel d’un rocher dans le sud de l’Islande.
La gravité
La force de gravité tend à faire tomber les objets vers le bas.
Elle contribue à la réduction de rochers en matériaux plus petits et fractionnés, augmentant aussi le contact avec l’air et les intempéries, ou les contacts avec la flore et la faune.
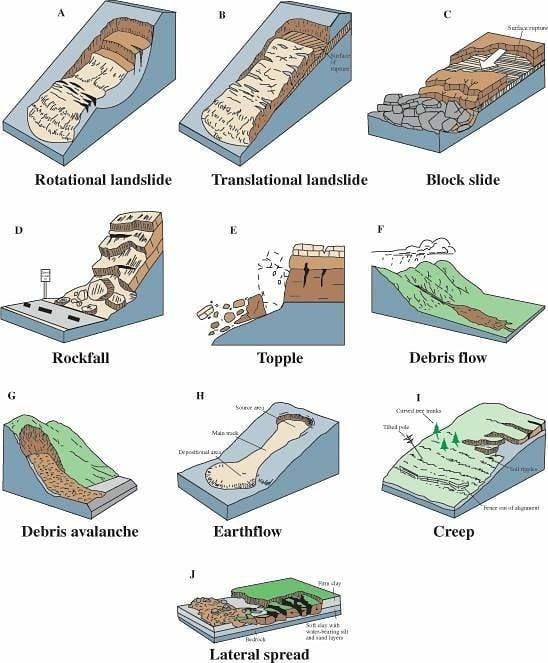
L’érosion par la gravité peut parfois être spectaculaire et meurtrier, à cause notamment des glissements de terrains, en milieu montagneux ; certains ont été malheureusement très célèbres.

Le biotope joue un rôle essentiel dans le cycle de l’or
Plus un biotope sera varié et riche, plus l’environnement sera humique et humide, plus l’écosystème sera préservé, et plus grandes seront les chances d’y trouver de l’or.
L’or est en symbiose avec la nature, et il n’est ni bucolique, ni poétique d’affirmer cela. Ce n’est pas un excès de bouffées de sensibleries pseudo-écologistes.
En effet, si nous nous basons uniquement sur des faits avérés, comme nous allons le voir, les végétaux, les bactéries, les champignons participent à l’érosion des roches en surface ou en profondeur, et surtout ce sont des « usines chimiques » qui produisent, transportent et concentrent de l’or dans la nature.
Non seulement ils le concentrent, mais aussi ils le raffinent, le titre de l’or secondaire est plus élevé que le titre d’un or primaire. C’est la raison pour laquelle les paillettes d’or de l’Ariège sont d’une grande pureté et dotées d’un titre très élevé.

A première vue, ce concept peut paraître étrange, mais il est vérifié et avéré par la communauté scientifique et par les géologues.
En effet, concrètement, s’il y a de l’or colloïdal invisible dans des roches du gisement qui se présente à nous, l’or peut se révéler et précipiter, dans certaines conditions physico-chimiques, directement à proximité du gîte aurifère étudié, ou bien à une certaine distance de celui-ci.
Cela est une conséquence des réactions chimiques avec l’or, opérées perpétuellement par les différents biotopes: plantes, arbres, racines, champignons, bactéries, mousses… avec toutes leurs interactions ou symbioses.
Je vais détailler ci-après quelques exemples de concrets de processus chimiques qui interagissent entre le biotope et le monde minéral.
Le rôle des végétaux, plantes et racines
Il a été prouvé, via de nombreuses études scientifiques, que de l’or circule dans la sève des plantes ou des arbres, grâce aux racines, et s’accumule dans les feuilles qui tombent pendant l’hiver.

Années après années, ses infimes particules d’or, emprisonnées dans les feuilles mortes, sont libérées par l’action de la décomposition, via les bactéries.
Ainsi, les arbres et les plantes sont des usines qui transportent de l’or depuis une grande profondeur, pour le libérer au final en surface. Années après années, cela peut représenter des stocks ou des accumulations relativement importantes.
Le rôle d’autres micro-organismes et des processus physico-chimiques vont ensuite déplacer, transporter, puis concentrer l’or sur place ou très loin à de grandes distances.
Il y a même des études qui ont été réalisées, et qui ont quantifié, notamment aux USA, dans les années 70’s, quelles espèces de plantes étaient les plus propices à l’absorption de l’or (voir les références en fin d’article).

Donc oui, dans les lieux aurifères, il y a de l’or dans le feuilles des arbres et des plantes, mais invisible, de dimensions moléculaires ou atomiques.
Il est bien établi que l’or se trouve dans la végétation ; des processus naturels existent par lequel l’or peut être solubilisé et absorbé par les plantes, les arbres les végétaux.
Il existe une corrélation entre l’or absorbé par les plantes et la stabilité du chlorure, du bromure et complexes de cyanure aurifères.
Le coefficient d’absorption augmente du chlorure au bromure en passant par les complexes de cyanure aurifères, qui correspond à l’ordre d’augmentation de la stabilité des complexes.
En résumé, l’or colloïdal n’est pas absorbé par les plantes, seul l’or à l’état ionique, associé à des complexes aurifères stables est absorbé par les plantes ou les arbres.
L’étude quantitative du nombre de particules (très petites) d’or dans les feuilles des plantes ou des arbres peuvent révéler la présence de gisements aurifères plus profondément enfouis, c’est le cas par exemple des arbres Eucalyptus.
Le chlorure et le bromure d’or peuvent être réduits par l’action des racines des plantes à pH 6,2.
Le complexe d’or le plus fortement absorbé est le complexe de cyanure.
Il est également disponible dans les zones aurifères habitées par des organismes cyanogéniques.
Les chlorures d’or
Dans certaines conditions, l’or sous forme de chlorure d’or à pH 6,2 est absorbé par les plantes, pour être stocké dans les feuilles.
Les bromures d’or
L’or dans les solutions de bromure d’or est plus facilement absorbé par les plantes.
Les iodures d’or
Les solutions d’iodure d’or et de thiocyanate d’or ont plutôt tendance à être toxique pour les plantes, et l’absorption d’or est plutôt irrégulière.
Les thiosulfates d’or
Le thiosulfate d’or se comporte de la même manière que le chlorure d’or.
Les cyanates d’or
Les solutions aurifères de cyanates d’or sont sont les mieux absorbées par les plantes.
Le rôle des bactéries
Les bactéries sont très présentes dans le biotope terrestre, dans les sols, le humus, et sont en interaction directe avec les racines des arbres ou des plantes.
Par exemple, certaines bactéries vont naturellement accumuler de l’or par la réduction de sulfates, en présence de thiosulfates d’or, et ce dans certaines conditions physico-chimiques.

Les bactéries jouent un rôle capital dans la formation de l’or supergène gluant, dont le titre est plus élevé et de meilleure pureté.
En outre, les bactéries d’oxydation de type thiosulfates ont un effet direct sur la stabilité et la qualité des complexes aurifères thiosulfates absorbés par les plantes et les arbres.
Ci-dessous: des mousses de bactéries observées dans un petit ruisseau aurifère au Québec. Il serait très intéressant de faire des échantillons d’analyses, pour voir s’il y a des nanoparticules d’or dans ces colonies de mousses bactériennes. Photos publiées grâce à l’aimable autorisation de Jérôme Gemme, un chercheur d’or au Québec. Merci pour ces partages utiles!
Les bactéries Cupriavidus metallidurans et Delftia acidovorans ne nourrissent d’or dissous aqueux en milieux métallifères et pollués, et peuvent, dans certaines conditions produire des petites particules d’or précipités ou coagulés.
Certaines firmes industrielles envisagent d’utiliser une bactérie marine nommée Marinobacter pelagius pour la production de particules d’or à partir de substrats métallifères pollués ou pour le recyclage de composants électroniques.
Enfin, la bactérie Chromobacterium violaceum augmente les possibilité de récupération de l’or de composants électroniques riches en métaux précieux ; des études ont été réalisées dans ce sens.
Certaines bactéries produisent littéralement des particules d’or en digérant des métaux toxiques.
Le rôle des champignons
Certains champignons interagissent avec les complexes aurifères des substances organiques des sols, et certains accumulent ou attirent l’or.
C’est le cas par exemple du champignon Fusarium Oxysporum, un champignon parasite terrestre qui provoque chez le bananier la maladie de Panama, appelée aussi fusariose du bananier ou jaunisse fusarienne. Ce champignon fongique a aussi un impact sur le plants de tabac en zones tropicales, et est responsable de graves problèmes agricoles.
La mobilisation chimique de l’or dans la nature
Nous y voilà, ça y’est, nous rentrons dans le coeur du sujet, la mobilisation et le transport chimique de l’or dans la nature, dans des conditions de solutions aqueuses.

L’eau est le véhicule qui va permettre aux substances chimiques aurifères dissoutes, de voyager parfois très loin à de longues distances de la source initiale du gisement aurifère, pour finalement coaguler ou précipiter plus bas dans la vallée, dans les forêts ou dans les plaines.
Ces processus peuvent prendre des dizaines, des centaines ou des milliers d’années.
Je vais détailler ci-après chacun des mécanismes en jeux.
Tellures d’or
L’oxydation des tellurides aurifères dans les zones hypergènes ou supergènes.

Chimie des tellures d’or
L’oxydation des tellurides aurifères peut donner de l’or soluble et de l’argent ou de l’or natif finement divisé (contenant de l’argent).
Cette réaction chimique produit aussi des tellurites et des tellurates.
Le tellure natif pourrait aussi être d’une origine supergène dans les zones oxydées de certains dépôts de tellurides aurifères.
La tellurite et la paratellurite sont des sous-produits de l’oxydation de la sylvanite et de la calaverite.

Sylvanite Nagyag Roumanie (4×2.8 cm) 
Callaverite – Creeple Creek – Colorado (USA) (2×1 cm)

Monocristal de tellurite. Mine de Moctezuma (municipalité de Moctezuma, État de Sonora, Mexique). Taille : 4,1 × 4,0 × 3,7 cm. 
Paratellurite, Moctezuma Mine (Bambolla Mine), Moctezuma, Mun. de Moctezuma, Sonora, Mexico
La réaction chimique est la suivante, qui libère de l’or natif:
AuTe2 + 2O2 => Au0 + 2TeO2
Les tellurides ferreux insolubles comme la emmonsite, malkayte, blakeite sont précipités avec une réaction catalytique grâce aux ions farriques Fe3+, avec les acides telluriques formés pendant l’oxydation des tellurides.
La réaction chimique est la suivante, qui libère de l’or natif:
AuTe2 + 2O2 + 2H2O => Au0 + 2H2TeO3
Les tellurates peuvent être précipités par des réactions avec l’acide tellurique formé par l’oxydation des tellurides, sous un haut potentiel d’oxydation.
La réaction chimique est la suivante, qui libère de l’or natif:
AuTe2 + 3O2 + 6H2O => Au0 + 2H6TeO6
Chlorures d’or
La migration de l’or grâce aux espèces hallides dissous, ainsi que par les complexes chlorures, car en effet, l’or peut se dissoudre dans des complexes chimiques chlorés.

Rutile et chlorite. Carrière de Trimouns, Luzenac, Ariège, Midi-Pyrénées, France. 
Cookéite, chlorite — Goutasson, Couledoux, Haute-Garonne
Chimie des chlorures d’or
La migration et le transport de l’or, grâce à son affinité avec les chlorures ou la chlorine, un phénomène chimique amplifié surtout en présence d’oxyde de manganèse ou de sulfate de fer ou de cuivre.
- Voici la réaction chimique de la formation des chlorures avec l’or, à partir de chlorures, d’hydrogène et d’or natif:
2 Au0 + 2H+ + 4Cl- => 2(AuCl2)- + H2
- La mobilité de l’or intervient aussi dans les eaux riches en chlorine qui a le pouvoir de dissoudre l’or et de le faire migrergrâce au manganèse, via cette réaction chimique:
MnO2 + 2Cl- + 4H+ => Mn2+ + 2H2O + Cl2
- La présence de manganèse peut, dans certaines conditions de pH, entrainer via les ions chlorures la dissolution de l’or , pour le transporter ailleurs, en milieux neutres, alcalins ou supergènes.
- Les sels ferriques comme le sulfate de fer solubilise l’or en présence de chlorures dissous, en conditions acides.
- Les ions ferriques Fe3+ maintiennent l’or dans un état oxydé qui est capable de s’associer avec es chlorures pour former des complexes solubles, par la réaction chimique suivante:
Fe3+ + Au0 => Fe2+ + Au+
Puis:
Au+ + 2Cl- => (Au Cl2)-
- Le sulfate ferrique Fe2(SO4)3 est un composant commun et courant dans la nature, dans les zones d’oxydation contenant des sulfures de fer et des sels dissous comme le chlorure de sodium NaCl chlorure de potassium KCl, qui sont présents dans certaines eaux oxydantes, ce qui veut dire que l’or peut être dissous en solution aqueuse, et être transporté facilement.
- Dans les dépôts cuivreux aurifères, l’or est dissous en présence de MnO2 (dioxyde de manganèse), via la réaction chimique suivante:
( SULFATE DE FER ou SULFATE DE CUIVRE ) + MnO2 + ( NaCl ou KCl ) + Sulfures => MIGRATION DE L’OR
- L’or de type supergène est souvent trouvé en association avec des halides argentifères, chlorargyrite, bromargyrite, et iodargyrite, ce qui suggère que l’or et l’argent ont été charrié grâce au chlorures, bromures ou iodures en environnement aqueux supergène.
Bromures d’or et les iodures d’or
Chimie des bromures et iodures d’or
Les bromures et surtout les iodures forment avec l’or des complexes plus stables que les chlorures.
Le brome est concentré dans les saumures résiduelles formées à partir des eaux évaporées par la chaleur solaire, tandis que l’iode est épuisé, vraisemblablement par oxydation des iodures pour donner de l’iode libre.
Le brome et l’iode sont concentrés dans les débris organiques.
L’iode se retrouve également dans la fraction colloïdale des sols et dans les boues marines.
Les plantes marines sont exceptionnellement riches en iode.
Les sédiments contenant les restes de ces plantes sont riches en iode.
L’iode est dérivé de sédiments marins néogènes qui se sont déposés en pleine mer à une certaine distance de la côte.
La désintégration de ces mauvaises herbes après l’enterrement par les sédiments a provoqué la libération de l’iode accumulé.
Avec l’ion bromure, la solubilité de l’or augmente indépendamment avec des concentrations croissantes d’ion bromure, d’ion hydrogène ou de dioxyde de manganèse, comme cela a également été observé dans l’étude sur les chlorures.
Avec l’ion iodure, la solubilité de l’or augmente indépendamment avec l’augmentation de la concentration de l’ion iodure et de l’ion hydrogène et diminue avec l’augmentation du dioxyde de manganèse.
Le dioxyde de manganèse oxyde l’ion iodure en iode, qui s’échappe du système.
La teneur en iode de nombreux sols est suffisante pour dissoudre l’or si l’iode est disponible sous forme d’iodure.
Dans les micro-environnements des sols, des concentrations d’iodure suffisantes peuvent être atteintes pour aboutir à une solution d’or sous forme aqueuse et son transport sur de longues distances.
Thiosulfates d’or
La migration de l’or peut aussi se faire grâce aux sulfures aurifères dissous (complexes THIO), pendant l’oxydation et l’altération des sulfures et des sulfosels.

Le thiosulfate est un ion métastable qui peut être formé par l’action de l’eau sur le soufre natif dans des solutions basiques. Les thiosulfates et les polythionates se trouvent couramment dans les sources chaudes de soufre alcalin.
Chimie des ions Thiosulfates
L’oxydation des sulfures métalliques peut entrainer la création de complexes chimiques, incluant les ions sulfures, les ions thiosulfates, les ions sulfates, les ions polythionates, cela dépend en fait de l’électro-conductivité et du pH.

L’action de l’érosion et de l’oxydation sur les sulfures métalliques, aboutissent à la formation de sulfates en bout de la chaîne:
SULFURES METALLIQUES => S2- => (S2O3)2- => (SO3)2- => (SnO6)2- => (SO4)2-
n = 2 ou 6
- Durant ces phases d’oxydation, un nombre important d’autres complexes peuvent aussi être formés comme HS- ou HSO43- et plus globalement d’autres espèces chimiques H-S-O, entraînant la dégradation des sulfures.
- Un nombre important de ces complexes chimiques font rendre l’or et l’argent soluble, dans un environnement à pH neutre ou alcalin, particulièrement: les ions HS-, (S203)2-, et (SO3)2-.
- Les complexes aurifères formés sont du type: [ Au (HS)2 ]- , [ Au (S2O3)2 ]3- , [ Au (SO3)2 ]3- , dans lesquels l’arsenic, l’antimoine sont abondants dans les dépôts aurifère de ce type.
- L’arsenic et l’antimoine sont abondants dans les dépôts aurifères de sulfures métalliques de type arseno-thio ou antimono-thio, comme par exemple: [ Au (AsS3) ]- , [ Au (Sb2S4) ]- .
- Ces complexes chimiques aurifères, en solution aqueuse ou en gels, vont faire migrer l’or et l’argent sous une forme chimique.
- Dans les milieux oxygénés ou supergènes, dans les dépôts argentifères, il y a la présence commune de pyrargyrite et de proustite.
- Les sels auriques Au3+ des anions oxydants ne sont pas vraiment stables, mais des complexes chimiques de sufates auriques sont connus du type [ Au (SO4) 2 ]- .
- Certains complexes peuvent être présents dans les zones de fort potentiel d’oxydation dans les zones de sulfures oxydés, mais aussi dans les endroits où H2SO4 est un oxydant là où il y a du MnO.
- Ces mécanismes de réactions chimiques confèrent à l’or une relativement bonne capacité de migration dans les corps de sulfures oxydés et ce sur des grandes distances.
- La migration de l’or dans les dépôts de sulfures aurifères est une conséquence de l’action des complexes chimiques thiosulfates et des sulfites.
- Les complexe de sulfates auriques peuvent aussi être un facteur de mobilité de l’or, on observe la précipitation d’or fin dans une solution aqueuse aurifère en réaction avec du sulfate ferrique.
- Des expériences chimiques menées en en rapport avec des solutions formées durant l’oxydation de différents sulfures naturel de plomb (galène), zinc (blende), et fer (pyrite).
- L’or dissous dans ses solutions aqueuses, spécialement quand des carbonates CaCO3 ont été rajoutés, l’or a été complexé sous des conditions alcalines grâce aux thiosulfates et polythionates formés durant la réaction des carbonates avec les produits des sulfures oxydés:
[ GALENE + BLENDE + PYRITE ] + [ H2O + O2 + OH- ] + [ CaCO3 ] => MIGRATION DE L’OR
ou énoncé différemment:
THIO- + OXYDATION + CARBONATES => MIGRATION DE L’OR

Formation de Thiosulfates d’or
Les espèces ioniques de soufre dans les sols sont dans un état constant de flux.
Les sulfates peuvent être réduits et le soufre élémentaire oxydé.
Une réaction intéressante ici est l’oxydation de S2- en (S2O3)2- par l’enzyme oxydase.
Une oxydase est une enzyme catalysant une réaction d’oxydo-réduction impliquant une molécule de dioxygène (O2) comme accepteur d’électron. Dans ces réactions, l’oxygène est réduit en eau (H2O) ou en peroxyde d’hydrogène (H2O2).
Les thiosulfates et les polythionates se produisent de façon transitoire dans les sols mais sont sujets à oxydation ou à réduction et ne s’accumulent pas ; la quantité varie de façon irrégulière avec le temps.
Les organismes capables d’oxyder les thiosulfates sont courants ; ils se produisent dans la plupart des sols, sur les rochers, en eau salée et en eau douce, et dans les sources minérales.
L’ion thiosulfate est le plus susceptible d’être trouvé dans des solutions presque neutres en équilibre avec H2S et (SO3)2-.
Dans les solutions acides, l’ion thiosulfate se dissocie en SO et iiS03-r et, à mesure que la solution approche d’un pH alcalin, les produits deviennent (HS)- et (SO3)2-.
Il faut cependant garder à l’esprit que les états stables du soufre dans la région oxydante acide sont H2S, S et (SO4)2-, et dans la région alcaline HS- et (SO4)2-.
Le thiosulfate résulte de la réaction de (SO3)2- et HS- produite par l’oxydation de la pyrite en présence de calcaire et, localement, il peut atteindre des concentrations adéquates pour dissoudre l’or.
Lors de l’oxydation à l’air des sulfures de fer, de plomb et de zinc, l’or était plus soluble dans un environnement CaCO3 qu’en milieu acide.
Le thiosulfate de calcium et les polythionates, formés lors de la réaction des carbonates avec les produits de l’oxydation des sulfures, sont des solvants de l’or.
Malgré la nature transitoire de l’ion thiosulfate dans une solution aqueuse supergène, l’or est conservé en solution pendant une longue période et, par conséquent, ces complexes ont une grande capacité de mobilité.
L’état métastable de l’ion thiosulfate et la rareté relative de l’ion sont compensés, en partie, par la stabilité de la capacité de migration du complexe d’or thiosulfate.
Pendant l’oxydation de la pyrite dans le calcaire, des concentrations adéquates de thiosulfate peuvent être atteintes pour dissoudre l’or.
En résumé, l’or est dissous par des solutions de thiosulfate de sodium dilué à des valeurs de pH supérieures à 5.
L’ion thiosulfate est présent dans des environnements à haute teneur en soufre mais généralement à de très faibles concentrations.
De nombreuses bactéries oxydent le thiosulfate et sont présentes dans la plupart des environnements superficiels.
Le thiosulfate d’or n’est pas absorbé de manière appréciable par les plantes.
Thiocyanates d’or
La migration de l’or grâce aux complexes organiques carbonés présents dans les végétaux.

L’or est facilement dissous en présence de l’ion thiocyanate, en particulier dans les solutions aqueuses acides.
Chimie des ions Thiocyanates
L’or est très soluble avec les substances organiques des végétaux et des sols (humus), il est en effet très soluble dans les cyanides et des thiocyanates.
- C’est le cas de substances suivantes: (Au(CN)2)- , (Au(Cn)4)- et (Au(CNS)4)- .
- Ces complexes chimiques peuvent être présents dans des zones oxydées avec une grande quantité de matières organiques dans le sol et les éluvions.
- Ces substances humiques peuvent solubiliser ou transporter l’or dans une forme absorbée aqueuse dans la sève des plantes ou des arbres, pour le déposer dans les feuilles.
- Si des complexes cyanides sont présents cela est transitoire à cause d’un pH relativement bas (acide), surtout dans des zones où des sulfures métalliques sont entrain de s’oxyder.
Le thiocyanate est largement distribué dans la nature et se produit normalement dans le sang, la salive et l’urine.
Le thiocyanate est présent en concentrations appréciables dans de nombreuses plantes et arbres.
Le potentiel d’oxydation relativement faible de l’or en présence de l’ion thiocyanate suggère que l’oxygène dissous dans l’eau serait un oxydant adéquat.
Les catalyseurs de la précipitation de l’or dans la nature

Voici les corps catalyseurs précipitant pour l’or dans la nature:
- Les sulfures altérés et oxydés: pyrites, chalcopyrite, blende, galène, arsénopyrite,
- L’acide carbonique, les carbonates,
- Le sulfate de fer,
- Les oxydes et hydroxydes de fer,
- L’acide humique,
- L’acide oxalique,
- Les hydrocarbures,
- La charbon,
- Le carbone,
- Le bitume,
- La lignite,
- La limonite,
- Les hydrocarbures,
- Le graphite,
- L’amphibole,
- Le feldspath orthose,
- La hornblende,
- Le manganèse,
- Les argiles et silicates,
- Les métaux réducteurs,
- Les corps supergènes.
Le Fer
Le fer présent en très grande quantité, joue un rôle capital dans la mobilisation et la précipitation de l’or dans la nature.






Minerais de fer et précipitation de l’or:
- Les minerais de fer: pyrite, arsenopyrite, pyrrhotite , sidérite, hématite, magnétite.
- Principes: La précipitation de l’or natif dans les solutions aqueuses ferreuses, là où le flux aurifère aqueux rencontre une zone riche en ions ferreux où une faible oxydation fait précipiter l’or.
- Précipitation de l’or en contact d’ion Fer:
Fe2+ + Au+ <=> Au0 + Fe3+
Principe de réactions chimiques:
- Ce type de réaction chimique est caractéristique des zones de dépôts de fer oxydés, plus ou moins profondes.
- Les mécanismes de précipitation de l’or semblent plus important dans les zones contenant des minerais de fer.
- C’est le même mécanisme de précipitation de l’or dans de nombreux cas, et aussi dans les zones de réduction de type sulfures supergènes.
- La pyrite aurifère, l’arsenopyrite, donnent de l’or secondaire, comme résultat d’un sous produit de la réduction par le sulfate de fer FeSO4.
- On observe la précipitation d’or fin dans une solution aqueuse aurifère en réaction avec du sulfate ferrique.



Les réactions chimiques se déroulent en 3 étapes:
- 1. OXYDATION DE SULFURES DE FER
PYRITE ou ARSENOPYRITE > H2SO4 + Fe2(SO4)3 ==> DISSOLUTION DE L’OR PRIMAIRE
- 2. REDUCTION DE L’OR DISSOUS AQUEUX
OR DISSOUS (Solution aqueuse) + FeSO4 ==> PRECIPITATION DE L’OR
- 3. HYDROLYSE DU FER
HYDROLYSE DU FER > PRECIPITATION DU FER ==> LIMONITE
NB. La limonite peut être un indice appréciable de zone de précipitation aurifère, surtout à proximité de pyrites et d’arsenopytite.


Le Manganèse ou Manganate
La précipitation de l’or dans les solutions aqueuses riches en ions manganèse et manganate ou permanganate, en milieux acides, neutres, ou alcalins aqueux.
La réaction chimique des ions auriques avec le manganèse et les ions hydroxydes est la suivante:
2Au+ + Mn2+ + 4OH- => 2Au0 + MnO2 + 2H2O
- L’or est absorbé en milieu oxydé par les oxydes de manganèse hydreux, en partitions très finement divisées et très rarement visibles ou observables.
- Il est possible d’observer sur les affleurements rocheux humides ou avec un filet d’eau, ou bien dans certaines rivières, des mousses, des filaments bactériens ou des plantes de couleur aux nuances violettes. Ce sont des indices visibles de présence de manganèse et de manganate dans la zone.

Je vous invite à lire cet article d’Orpaillage Pyrénées la fièvre publié sur Facebook ici: https://www.facebook.com/Ronstefor/photos/?tab=album&album_id=1368127283217071

L’absorption et/ou la co-précipitation des colloïdes et des complexes aurifères chargés négativement, par des gels chargés positivement comme les hydroxydes ferriques aqueux et la limonite.
OXYDES DE FER et/ou OXDES DE MANGANESE => PRECIPITATION DE L’OR + LIMONITE
- Ces mécanismes chimiques apparaissent particulièrement avec des oxydes gélatineux aurifères situés dans ou à proximité de dépôts enrichis en or.
- Aussi, l’or gélatineux d’oxydes de manganèse absorbe et fait aussi précipiter l’or.
- Les anions d’or peuvent être absorbés par la charge positive des oxydes de manganèse hydreux.
- En présence de fer et de manganèse, chargés positivement, les comlexes d’or chargés négativement auront tendance à être attiré et absorbés, ce qui entraine la précipitation de l’or et de l’argent en filament, ou en particules très fines.
Les argiles et les silicates
Les minéraux argileux ou les silicates gélatineux tendent aussi à concentrer l’or dans lesquels il peut précipiter.

Argile aurifère, en Occitanie, dans le Sud Ouest de la France. Ce dernier contient des paillettes d’or fin très petites. 
Terre argileuse aurifère rouge et oxydée, renfermant des paillettes d’or en son sein. Bretagne, France. 
De l’argile blanche et riche en quartz, et contenant des paillettes d’or fin. En Bretagne, France.



Un article spécial sur la recherche de l’or dans les argiles est disponible ici.
MILIEU SUPERGENE + ARGILES + SCILICATES => PRECIPITATION DE L’OR
- De nombreuses argiles peuvent contenir de l’or comme expliqué dans cet article ici.
- Les silicates sont riches en oxygène et en silice: quartz, quartz rose, quartz fumé, améthyste, calcédoine, agate, opale, orthose, microcline, anorthose, albite, oligoclase, anorthite, labradorite, andesine, serpentine, chryotile, talc, mica, biotite, bentonite, kaolinite, diopside, augite, hornblende, tourmaline, béryl, épidote, olivine, cyanite, grenat.
- Indices aurifères: les quartz, la tourmaline, l’olivine, l’augite, la hornblende, le grenat, la biotite, les micas, sont des indices importants dans le cadre de la prospection aurifère.
- Les argiles présentant des débris mélangés de roches ou de minéraux riches en silices sont en général d’excellents indices, pour y faire des recherches.
- On trouve fréquemment des gisements, des fissures, des grappes, ou filons, composés de minéraux argileux, regroupées en zones oxydées, qui peuvent être des dépôts aurifères. Ils sont souvent mélangés à des roches ou minéraux siliceux.
- Les groupes et les dépots argileux le long des failles tendent à concentrer l’or dans les zones les plus oxydées, via des processus d’absorption et de précipitation naturel.
Les Sulfures
Les sulfures métalliques sont une grande famille, et leur présence dans la nature est une bénédiction en tant que ressources minérales ; si on prend plus de recul, on peut affirmer que comme avec le pétrole et le gaz, l’humanité est complètement dépendante des sulfures métalliques (pareil pour les oxydes métalliques).

Les sulfures: pyrite, chalcopyrite, arsénopyrite, blende, galène argentifère, arsenopyrite, pyrrhotite, sidérite…

Ci-dessous: des nodules de pyrite (sulfure de fer), très oxydés, et qui sont des indicateurs utiles dans le cadre de la prospection aurifère, d’ailleurs, la rivière est aurifère. Photos publiées avec l’aimable autorisation du chercheur d’or Jérôme Gemme, basé au Québec.
Les variations du pH et l’évolution de l’acidité dans les solutions aqueuses en provenance des roches altérées, dues à l’oxydation des sulfures:
- a pour conséquence la production d’acide sulfurique H2SO4,
- la réaction d’hydrolyse du sulfate ferrique qui produit lui aussi du H2SO4,
- mais aussi des réactions chimiques avec la gangue des minéraux du rocher encaissant, qui tendent à neutraliser ou rendre la solution aqueuse alcaline.
L’oxydation de la pyrite de fer par l’oxygène, l’eau ou les hydroxydes, a pour conséquence la formation d’acide sulfurique:
FeS2 + 02 + H20 + OH- => H2SO4
Ce principe de base fonctionne pour tous les sulfures, nous pourrions la décliner pour les différents cas.
Les règles des variations du pH qui régissent la précipitation de l’or:
- BASIQUE: Une augmentation du pH des solutions aqueuses détruit les chlores complexes aurifères et fait précipiter ou coaguler l’or natif.
BASIQUE: pH ↗ => Destruction des chlorides => PRECIPITATION DE L’OR
- ACIDE: Une baisse du pH (acidification) de la solution aqueuse, a tendance à détruire les complexes alcalins aurifères comme ( AuS )- , ( Au (HS)2 ) , les thiosulfates, les sulfures, et cela entraine la précipitation de l’or.
ACIDE: pH ↘ => Destruction des (AuS)- , (Au(HS)2) , Thio-, Sulfures => PRECIPITATION DE L’OR
Exemple de pyrites jaunes de sulfures de fer, en Ariège:

Un conglomérat schisteux très ancien oxydé riche en quartz, en Ariège, dans le Couserans. 
Une fois broyé, et lavé au pan, on y trouve des pyrites jaunes de sulfures de fer.
Un autre sulfure important: la galène argentifère, souvent associé à de la pyrite et de la chalcopyrite, en Ariège.

Galène provenant des mines de Joplin, Missouri, États-Unis (6,3x6cm). 
Galène, mine de Huaron, Pérou (23×13cm).
Ci-dessous: Exemple de concrétions de cuivre natif et de fer, dans un gisement aurifère de sulfures massifs ; découvertes faites au Québec. Photos publiées grâce à Jérôme Gemme, un prospecteur d’or implanté au Québec. Merci pour sa contribution utile.
Les substances gélatineuses
La coagulation ou la précipitation de l’or colloïdal par de nombreux ions chargés, dans les sols et les gels métallifères ou carbonés.
- De nombreuses autres substances gélatineuses tendent à faire coaguler et à précipiter l’or dans la nature.
- C’est de cas des gels humiques, gels limonitiques, gels alumino-humico-limonite, gels ocres de bismuth, gels ocres de tellurium, gels d’antimoine amorphe, gels d’ocres d’arsenic.
- Le principe d’absorption et de précipitation est largement due à l’absorption de l’or par ces substances gélatineuses.
- L’or métallique colloïdal charrie une charge négative, et un potentiel positif réside intrinsèquement dans les minéraux d’argiles, pareil pour les oxydes de fer hydreux, et d’autres substances à ions positifs chargés.
- Les sols, les gels peuvent effectivement faire coaguler et précipiter l’or, naturellement, entrainant la formation de paillettes, grains ou pépites d’or.
- En règle général, l’or précipite en présence d’ions positifs.
Les métaux réducteurs
La précipitation de l’or due à la présence de différents métaux réducteurs.
- L’or est précipité dans les solutions aqueuses des dépôts aurifères en présence de sulfures, de carbonates, de métaux natifs, de silicates, de tellures, d’arsenates, d’antimonates, de minéraux argileux ou de substances carbonnées.
- Il en est de même en présence d’oxydes hydreux supergènes.
- L’or dissous est précipité sous la forme d’un nucléi d’or natif minuscule, qui continue à croitre et à pousser en dendrites ou en cristaux ou filaments.
- Cet or natif grandissant par l’apport des ion d’or des solutions aqueuses, entraine alors la création « spontanée » de poussières, plaquettes, paillettes, grains ou pépites d’or.
- Le nucléi peut être un grain minuscule, un fil métallique très fin, une petite racine.
- Dans la plupart des veines de filons minéralisés métalliques, l’or aura tendance à être précipité, sous la forme de particules finement divisées, en présence de matériaux désintégrés de sulfures, limonite, ocres oxydées ferreuses, argiles, hydroxydes ferreux, pour résumer, toujours dans un environnement très oxydé, de type supergène.
Ci-dessous: des paillettes d’or cristallisées et dendritiques, formées autour d’un nucléus. La cristallisation opère de l’intérieur vers l’extérieur, par couches successives. Cela peut prendre des centaines ou des milliers d’années. Paillettes d’or fin en provenance d’Ariège, du Couserans, dans les Pyrénées.
Les minéraux supergènes
La co-précipitation ou l’absorption de l’or dans les par de nombreux minéraux supergènes.
- Minéraux supergènes: bismutite, chlorargyrite, jarosite, malachite, azurite, gypse, sulfures, pyromorphite, scorodite, phosphates, vanadates, arsenates, antimonates,…
- Souvent sous la forme de poussières d’or ou d’or très fin, très petit.
Exemples de roches et minéraux supergènes existants dans la nature:

Cristaux de malachite, Congo 
Pyromorphite – Mine de Saint-Salvy, Tarn 
Bismutite de Schneeberg, Allemagne 
Azurite (« chessylite ») (8 × 6 cm) de Chessy-les-Mines dans le Rhône, topotype de ce minéral 
Arignac Ariège – Macle, Gypse
Le Carbone
Le graphite, le charbon, les hydrocarbures, le bitume, la lignite auront tendance à faire coaguler et à précipiter l’or aqueux.
Les Sulfates
Le sulfate de fer est un puissant catalyseur pour la précipitation de l’or.
Conclusions
Il est très important pour un chercheur d’or ou un prospecteur de bien comprendre les cycles de la chimie de l’or dans la nature, et les différents processus de mobilisation ou de précipitation de l’or.
Comprendre ces différentes notions, permet l’étude et la recherche de gisements aurifères, et ce dans différents contextes géologiques.
Il faut bien prendre la mesure du rôle fondamental de la nature et du biotope, en effet un écosystème naturel riche en plantes et en végétaux, avec un humus important, amplifie la génération de l’or par précipitation mais aussi sa mobilité.
L’or a besoin des plantes, des champignons, des bactéries, de l’humus et de substances organiques plus ou moins complexes pour être mobilisé et pour être concentré.
Ainsi, tout bon chercheur d’or ou prospecteur devrait, par définition, respecter la nature et l’écologie des environnement dans lequel il procède à ses investigations et travaux.
C’est à dire ne jamais négliger le rôle des arbres, des plantes, des racines, des bactéries et des champignons, qui déplacent, raffinent et concentrent l’or. Un sol sans vie végétale ni biotope ne produit et ne génère pas d’or.
Certains agents chimiques catalysent, dans certaines conditions physico-chimiques, la précipitation de l’or, ce sont ces endroits dans lesquels il faut chercher et privilégier en priorité.

Références
Voici l’ensemble des documents, sources et des références qui ont inspiré la rédaction de cet article. Je vous en recommande les lectures attentives.
Beaucoup de lectures les amis mais cela en vaut largement la peine, surtout pour les néophytes.
Articles scientifiques et thèses:
- Geochemistry of gold in the weathering cycle, par Hubert W. Lakin, Gary C. Curtin et Arthur E. Hubert, du Geological Survey Bulletin 1330, publié en 1974: https://pubs.usgs.gov/bul/1330/report.pdf (en version PDF).
- The effect of thiosulfate-oxydizing bacteria on the stability of the gold-thiosulfate complex, par Maggy F. Lengke et Gordon Southam, publié par le Department of Sciences, University of Western Ontario, Canada, publié en 2004: https://www.researchgate.net/publication/222679505_The_effect_of_thiosulfate-oxidizing_bacteria_on_the_stability_of_the_gold-thiosulfate_complex (Sur Researchgate.net)
- Bioaccumulation of gold by sulfate-reducing bacteria cultured in the presence of gold(I)-thiosulfate complex, par Maggy Lengke et Gordon Southam, publié dans la revie ELSEVIER en 2006: https://www.researchgate.net/publication/251309189_Bioaccumulation_of_gold_by_sulfate-reducing_bacteria_cultured_in_the_presence_of_goldI-thiosulfate_complex (Sur Researchgate.net)
- Biosynthésis of gold nanoporticles: a review, par Maggy F. Lengke, Charoen Sanpaxanitchakit, et Gordon Satham, en 2011: https://www.researchgate.net/publication/226101864_Biosynthesis_of_Gold_Nanoparticles_A_Review (Sur Researchgate.net)
- Cupriavidus metallidurans: evolution of a metal-resistant bacterium, par Von Rozycki et Nies DH, source PUBMED: https://www.researchgate.net/publication/23295319_Cupriavidus_metallidurans_Evolution_of_a_metal-resistant_bacterium
- The in vitro formation of placer gold by bacteria, écrit par Gordon Southam et Terrance J. Beveridge, du Department of Biological Sciences en Arizona, en 1994: https://www.sciencedirect.com/science/article/abs/pii/0016703794903557
- Exploitation of marine bacteria for production of gold nanoparticles, écrit par Nishat Sharma, Anil Kumar Pinnaka, Ashish Ashish, Manoj Raje, et publié en 2012 par Researchgate.net: https://www.researchgate.net/publication/227707127_Exploitation_of_marine_bacteria_for_production_of_gold_nanoparticles
- Natural gold particles in Eucalyptus leaves and their relevance to exploration for buried gold deposits relevance to exploration for buried gold deposits, par Melvyn Lintern, Ravi Anand, Chris Ryan, David Paterson, publié en 2013 par la revue Nature: https://www.nature.com/articles/ncomms3614
- The smallest gold-diggers in the world, écrit par Richard Noorden, publié en 2006, dans le revue Nature: https://www.nature.com/news/2006/060710/full/060710-13.html
- Gold-digging bacterium makes precious particles, par Ewen Callaway publié dans la revue scientifique NATURE, en 2013: https://www.nature.com/news/gold-digging-bacterium-makes-precious-particles-1.12352
- Bacteria produce gold by digesting toxic metals, par Martin-Luther-Universität Halle-Wittenberg: https://phys.org/news/2018-02-bacteria-gold-digesting-toxic-metals.html
- Fungus that draws gold from its surroundings discovered in Western Australia, écrit par CSIRO publié par THE GUARDIAN: https://www.theguardian.com/science/2019/may/24/fungi-that-draws-gold-from-its-surroundings-discovered-in-western-australia
- Gold particles in Eucalyptus trees can reveal deposits deep underground, écrit par Joseph Sttomberg, et publié en 2013: https://www.smithsonianmag.com/science-nature/gold-particles-in-eucalyptus-trees-can-reveal-deposits-deep-underground-3481702/
- Researchers Discover Bacteria That Produces Pure Gold, par Geologyin: https://www.geologyin.com/2016/03/researchers-discover-bacteria-that.html
- Pour trouver de l’or, suivez ce champignon !, écrit par Céline Deluzarche, journaliste, publié en 2019 dans FUTURA SCIENCES: https://www.futura-sciences.com/planete/actualites/geologie-trouver-or-suivez-ce-champignon-43373/
- Gold dissolution from ore with iodide-oxididing bacteria, de Sann Yee Khaing, Yuichi Sugai et Kyuro Sasaki, publié par Researchgate.net: https://www.researchgate.net/publication/331689359_Gold_Dissolution_from_Ore_with_Iodide-Oxidising_Bacteria
- Evidence of fungi and gold redox interaction under Earth surface conditions, publié en 2019 par la revue scientifique Nature: https://www.natureindex.com/article/10.1038/s41467-019-10006-5
- Enhancing gold recovery from electronic waste via lixiviant metabolic engineering in Chromobacterium violaceum, par Song Buck Tay, Gayathri Natarajan, Ht Tan, Muhammad Nadjad bin Abdul Rahim, publié sur Researchgate.net: https://www.researchgate.net/publication/250920355_Enhancing_Gold_Recovery_from_Electronic_Waste_via_Lixiviant_Metabolic_Engineering_in_Chromobacterium_Violaceum
- Lamprophyres a source of gold, écrit par D. Wyman et R. Kerrich en 1988 dans Nature: https://www.nature.com/articles/332209a0.pdf?origin=ppub
- Une bactérie qui vaut de l’or, publié par Joël Ignasse dans SCIENCES ET AVENIR: https://www.sciencesetavenir.fr/nature-environnement/une-bacterie-qui-vaut-de-l-or_9650
- Les anciennes mines de plomb argentifère de l’Ariège, par Claude Dubois, publié en 1997: https://www.persee.fr/doc/palla_0031-0387_1997_num_46_1_1445 (Sur Persee.fr)
- Mesozoic vein-type Pb-Zn mineralization ine the Pyrennees: lead isotopic and fluid inclision evidence from the Les Argentières and Lacore deposits, écrit par Marguerite Munoz, Sandrine Baron, Adrien Boucher et didier Béziat, publié en 2015 par GEOSCIENCE dans ELSEVIER: https://www.sciencedirect.com/science/article/pii/S163107131500098X
- Les principaux niveaux minéralisés (Zn, Pb, Cu, Ba) du Paléozoïque des Pyrénées centrales: éléments de synthèse, par Georges Pouit, Christian Boucquet et Jean-Pierre Bois, en 1979 par le BRGM.
- Arrens Zn (Pb), Ba Devonian deposit, Pyrénées, France: an exhalative-sedimentary-type deposit similar to Meggen, par G. Pouit & J.-P. Bois, en 1986: https://link.springer.com/article/10.1007/BF00199798
- Place des métaux stratégiques dans l’histoire hercynienne des Pyrénées: l’exemple du dôme de Bossost (Haute-Garonne), par Alexandre Cugerone en 2016: http://rgf.brgm.fr/sites/default/files/upload/documents/production-scientifique/Masters/rgf_amipyr2015_ma1_memoire_cugerone.pdf
- Revalorisation du potentiel minier français Revue et cartographie prédictive pour W, Au et Ge dans les Pyrénées, par le BRGM en 2016: http://www.mineralinfo.fr/sites/default/files/upload/documents/Rapports_BRGM/revue_et_cartographie_predictive_pour_w_au_et_ge_dans_les_pyrenees.pdf
- Les minéralisations ZN-Pb exhaltives sédimentaires de Bentaillou et de l’anticlinorium paléozoïque de Bosost (Pyrénées ariégeoises, France), par Georges Pouit, publié en 1986.
- Les minéraux en trace de Ni-Co, Sn, Ge-Ga, Pb-Sb, Ag et Au témoins de l’évolution de l’hydrothemalisme de l’Ordovicien au Dévonien dans les minéralisations zincifères des Pyrénées Centrales, par Elisabeth Oudin, Georges Pouit, Francis Tollon, en 1988: https://www.persee.fr/doc/bulmi_0180-9210_1988_num_111_1_8070
- Note sur le gisement de zinc et plomb de la concession de Sentein et Saint-Lary (Ariège), par Jean Lougnon, publié en 1954 par le BRGGM.
- La minéralisation des Pyrénées Centrales par E. Oudin, rapport du BRGM publié en 1982: http://infoterre.brgm.fr/rapports/82-SGN-189-MGA.pdf
- Inventaire et typologie des minéralisations du Paléozoïque des Pyrénées (Zone Nord et Est de Bassies – France) par G. Pouit, publié par le BRGM en 1982: http://infoterre.brgm.fr/rapports/82-SGN-668-GMX.pdf
Histoire et archéologie:
- Premier mémoire sur l’or retiré de l’Ariège, de DIETRICH (DE) Baron, des éditions Lacour Rediviva. Disponible ici.
- Ariège – Pyrénées MUSSY (M.), 1864 – Gîtes métalliques du Saint-Gironnais, Pages 80, 81, 82,83, disponible ici.
- Au Pays des Hommes et du Fer, le livre intitulé Richesses et exploitations minières en Ariège, Tome 1 et Tome 2, du géologue Henri Tabarant. Il sont devenus introuvables.
- Etudes historiques sur l’ancien pays de Foix et le Couserans, de Adolphe Garrigou, 1856, des éditions Lacour Rediviva. Disponible ici.
- Etudes historiques sur l’ancien pays de Foix et le Couserans limites de l’ancienne Aquitaine et de la Province Romaine du temps de Jules César, de Adolphe Garrigou, 1856, des éditions Lacour Rediviva. Disponible ici.
- Vallées ariégeoises avant l’invasion romaine, de Adolphe Garrigou, 1856, des éditions Lacour Rediviva. Disponible ici.
- Le gisement et le traitement direct des minerais de fer dans les Pyrénées & l’Ariège (Ed 1843), Hachette Livre, BNF, de Jules François.
- Dans les cavernes des Pyrénées ariégeoises, par F. Garrigou, de Tarascon (Ariège) et H. Filhol, des éditions Lacour/Rediviva, en 1998: http://www.editions-lacour.com/
- La mine de cuivre gallo-romaine du Goutil, à la Bastide-de-Sérou (Ariège), par Jean-Emmanuel Guilbaut, en 1981: https://www.persee.fr/doc/galia_0016-4119_1981_num_39_1_1826
- Les mines de plomb argentifère et zinc d’Aulus-les-bains (Ariège), de Claude Dubois: https://www.persee.fr/doc/amime_0758-7708_1999_num_17_1_928
Livres:
- Le livre français édité par le b, écrit par Christian Guiollard, et intitulé le Guide pratique du chercheur d’or en France, cet ouvrage est le minimum requis. Il y a un large chapitre de cours sur l’or alluvionnaire. Disponible sur le site de la Fnac.
- Roches et paysages, reflets de l’histoire de la Terre, de François Michel, des éditions du BRGM: https://www.amazon.fr/Roches-paysages-Reflets-lhistoire-Terre/dp/2701140811
- Le livre américain intitulé Handbook For Gold Prospectors in Washington, écrit par WAYNE S. MOEN and MARSHALL T. HUNTTING, en 1975. Lien du PDF ici: http://www.dnr.wa.gov/Publications/ger_ic57_handbook_gold_prospectors.pdf
- Un excellent document intitulé Placers and gold déposits in Arizona, rédigé en langue anglaise, écrit par MAUREEN G. JOHNSON, en 1972. Lien du PDF ici: https://pubs.usgs.gov/bul/1355/report.pdf
- Je vous recommande aussi la lecture attentive du livre sur l’orpaillage de P. Proust, datant de 1920, intitulé Prospection, gisements, extraction de l’or, des éditions Gauthier-Villars et Cie. Livre disponible ici.

NB. Pour des raisons évidentes de préservation des lieux sauvages et des biotopes, je ne divulguerai pas les localisations précises de mes recherches.
Car je tiens à conserver en l’état et à l’abris des curieux, des touristes, des fâcheux, de vénaux ou des mercantiles ces endroits magnifiques et magiques.
Si vous orpaillez, rebouchez vos trous! Respectez l’environnement et ne laissez aucune trace de votre passage!
Copyrights: ©Vivien Laïlle / ©Goldsnoop.com 2019, droits réservés.
Crédits photographiques: ©Vivien Laïlle / ©Athos Hellgoth / ©Jérôme Gemme / ©Wikipedia